無線・無電極バイオセンサの開発
ヒトDNAの解析がほぼ完了した現在,ガンや神経変性疾患,感染症に深くかかわるたんぱく質の研究が集中的に行われており,多くの疾患に特有のたんぱく質や抗体が次々と特定されています.最終的には,血液中や尿中に漏洩したこれら特定のたんぱく質を検出することにより,疾患の早期の発見が可能となります.疾患の早期の発見は効果的な治療のためには極めて重要であることは言うまでもありませんが,長期的に見れば膨大な医療費の削減にもつながります.X線CTやMRIなど,現在主流となっている診断法は,患者に精神的・肉体的・経済的負担を強いるものであり,しかも,診断結果には主観が加わり,いわゆる「見落とし」も少なくありません.したがって,簡便な血液・尿検査によって絶対的に診断が可能となればその意義の大きさは計り知れません.
また,疾患特有のたんぱく質の中には,たんぱく質そのものが病気の直接的な原因となるものも少なくはありません.例えば,アルツハイマー病においては,アミロイドβやタウたんぱく質が凝集し,脳の神経細胞に支障を与えることが知られています.このような病気の根源となる抗原たんぱく質が特定されれば,それと親和性の高い(つまり,治療効果の高い)抗体を開発することにより,患者各個人に対して効果的な免疫治療が可能とります.この際,生体内環境において,抗原・抗体反応の親和性を正確に測定する必要があります.
以上の背景を受けて,私たちは
- 溶液中のたんぱく質を簡便,短時間,かつ,高感度に検出することができ,
- 生体分子間反応をリアルタイムにモニタリングし,反応の熱力学的諸量(平衡定数,親和定数,解離定数など)を正確に決定することのできる,
革新的な振動子バイオセンサを創製し実用化することを目指しており,すでにいくつかの重要な結果を得ています.
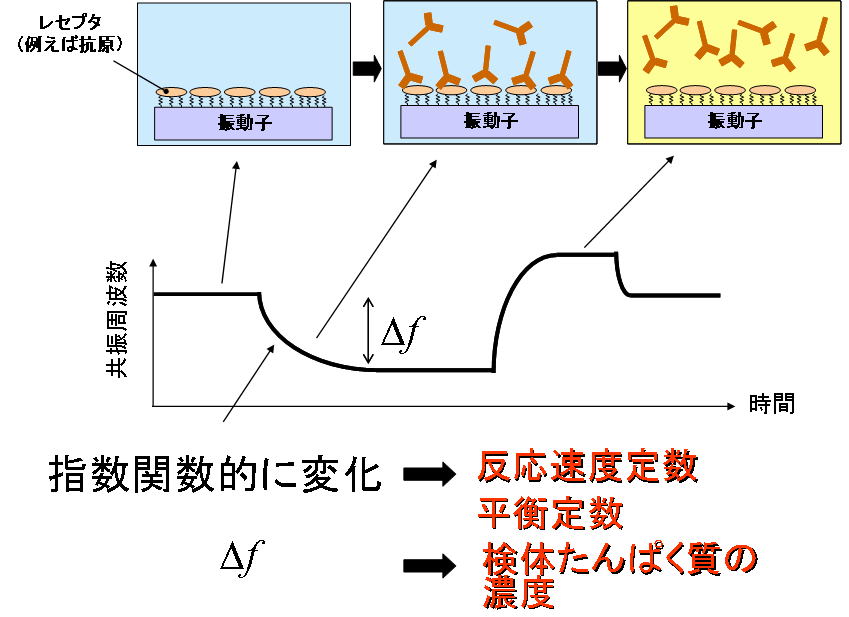
では,まず一般的な振動子バイオセンサの原理を説明します(図1参照).
- 電極を両面に成膜し,配線を取り付けた圧電振動子を準備します.圧電振動子としては,温度安定性の高いATカット水晶などが使用されます.
- 振動子の表面に,検体たんぱく質と特異的な結合を示すレセプタたんぱく質を固定化します.例えば,検体たんぱく質が抗体である場合,レセプタはそれに対する抗原を用いることができます.固定化には,シランカップリング法や自己組織化単分子膜などが使用されます.
- この振動子をセルに設置して,共振周波数を測定します.共振周波数は安定後は一定値を保ちます.
- この状態で検体たんぱく質を含む溶液をセル内に流し込みますと,生体分子反応により,検体たんぱく質は振動子表面に吸着されます.すると,振動子の表面の有効質量が増加し,慣性抵抗が増しますので,振動子の共振周波数が減少します.共振周波数は,生体分子反応が疑一次反応的に起こるのであれば,指数関数的に変化します.この指数係数は反応速度定数を反映します.
- 強酸,強アルカリ,尿素などの解離剤を流し込みますと,たんぱく質間の結合は解離され,共振周波数は元の値に戻ります.
- センサは再生され,何度も検体たんぱく質の検出を行うことができます.
振動子センサにおいて決定的に重要な点は,
- 質量を絶対的に検出することができる.
- 検体に対して標識を付加する必要がない.
- 周波数変化量(Δf)より検体の濃度を知ることができる.
- 周波数の変化の仕方から生体分子反応の親和性や速度定数といった反応に関わる重要な量を定量的に決定することができる.
ということです.特に,最後の点は,振動子センサの大きな利点であり,他のいかなる手法(ELISA法や表面プラズモン共鳴法など)において決定される値よりも信頼性があります.
このように,振動子センサは魅力的なバイオセンサなのですが,重大な欠点があります.それは,質量検出型のバイオセンサであるために,抗体やDNAなどの分子量の大きい物質の検出に対しては感度が良いのですが,分子量の小さなたんぱく質に対しては感度が悪いということです.そもそも振動子センサの感度とは,「同じたんぱく質濃度に対していかに大きな周波数変化を得るか」ということであり,つまり,共振周波数の変化率が感度の指標となります.低周波の振動子センサにおいては,粘性の影響が多大に周波数変化に加わりますが,高周波の振動子センサにおいては,粘性の影響は無視できるようになり,周波数の変化率は正確に以下の式により与えられます:
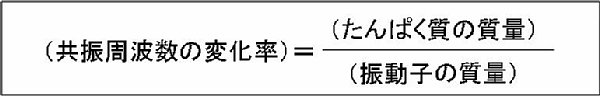
つまり,振動子センサの感度を向上させるためには「振動子を軽くする」必要があります.振動子にはある程度の有効面積が必要ですから,これはつまり,「振動子を薄くする」ということに帰着されるのです.
近年の加工技術やエッティング技術においては,振動子を薄くすることぐらい朝飯前のような気がしますが,実際これは大変難しいのです.というのは,技術的に振動子を薄くできたとしても,電極や配線を無くす訳にはゆきませんから,これらが感度限界を作ってしまうのです.電極としては電気抵抗が良く,金-チオール反応が使用できるAuやPtが使われますが,例えばAuは密度が水晶の7倍以上もあり,非常に重いのです.そういった重い電極が振動子の表面に存在するわけですが,都合の悪いことに,表面は振動の加速度の最も大きい位置であり,非常に大きな慣性抵抗をが発生し,振動を妨げます.また,金属のQ値は小さく(つまり摩擦が大きい),金属が振動系に加わることにより,振動系のQ値は低下し,共振周波数の測定精度が悪くなります.つまり,振動子は「非常に重く非常に粘性の大きい錘」を乗せて高周波で振動しなければならず,これにより振動子をいくらでも薄くするというわけには行かなくなるのです.この欠点は従来の振動子センサにおいては原理的に不可避であり,その結果,検出限界が存在したのです.
結局,もっとも明快かつ確実な解決法は,諸悪の根源であった「電極と配線」を無くしてしまえば良いのです.つまり,「無線・無電極化」です.私たちは,アンテナ技術を駆使して,振動子の無線・無電極(つまり非接触)測定技術を確立しました.これにより,従来と比較して大幅に感度の高いバイオセンサを創製することに成功したのです.詳細は文献にて示しております.
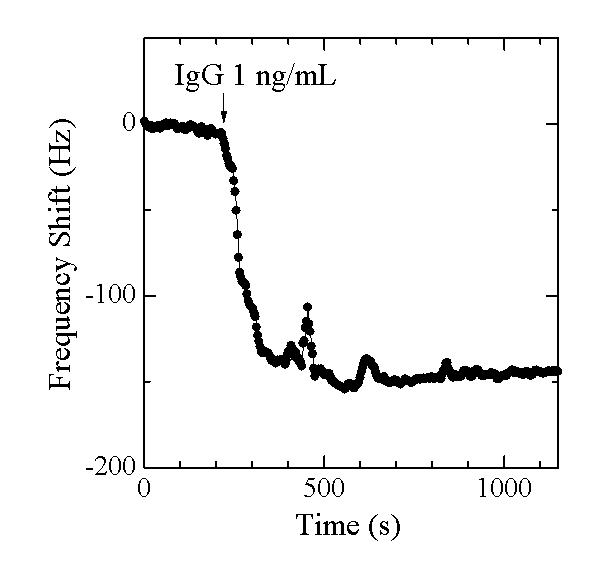
例えば,下図は1ng/mLの濃度のヒトIgG溶液を50μmの無線無電極ATカット振動子(基本周波数約34MHz)によって測定した例です.振動子表面にはヤギ由来抗ヒトIgGを固定化しました.IgG溶液がセルに到達すると共振周波数が指数関数的に減少している様子が分かります.
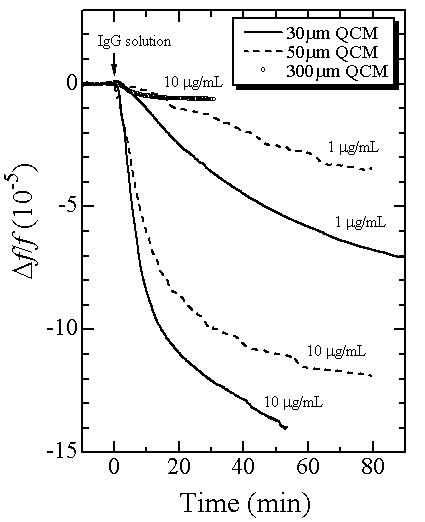
下図は3種類の厚さの無電極ATカット水晶板を用いて,濃度10および1 μg/mLのhIgG溶液を注入したときの周波数変化の様子を比較しています.明らかに水晶振動子の厚さの減少と共に周波数変化量が増加し,振動子の薄型化により大幅な感度向上が可能であることを示しています.
<参考文献>
- H. Ogi, K. Okamoto, H. Nagai,Y. Fukunishi, and M. Hirao, "Replacement-Free Electrodeless QCM Biosensor Using Nonspecific-Adsorption of Streptavidin on Quartz", Anal. Chem. in press.
- H. Ogi, Y. Fukunishi, H.Nagai, K. Okamoto, M. Hirao, and M. Nishiyama "Nonspecific-Adsorption Behavior of Polyethylenglycol and Bovine Serum Albumin Studied by 55-MHz Wireless-Electrodeless Quartz Crystal Microbalance", Biosens. Bioelectron. in press.
- H. Ogi, K. Hatanaka, Y. Fukunishi, H. Nagai, M. Hirao, and M. Nishiyama "Aggregation Behavior of Amyloid beta 1-42 Peptide Studied by 55-MHz Wireless-Electrodeless Quartz-Crystal Microbalance", Jpn. J. Appl. Phys. in press.
- H. Ogi, Y. Fukunishi, T. Omori, K. Hatanaka, M. Hirao, and M. Nishiyama, "Effects of Flow Rate on Sensitivity and Affinity in Flow-Injection Biosensor Systems Studied by 55-MHz Wireless QCM", Anal. Chem. 80, 5494-5500 (2008).
- H. Ogi, T. Omori, K. Hatanaka, M. Hirao, and M. Nishiyama, "Detection of Glypican-3 Proteins for Hepatocellular Carcinoma Marker Using Wireless-Electrodeless Quartz Crystal Microbalance", Jpn. J. Appl. Phys. (2008) in press.
- H. Ogi, K. Motohisa, K. Hatanaka, T. Ohmori, M. Hirao, and M. Nishiyama, "Concentration Dependence of IgG-Protein A Affinity Studied by Wireless-Electrodeless QCM", Biosens. Bioelectron. 22, 3238–3242 (2007).
- H. Ogi, K. Motohisa, K. Hatanaka, T. Ohmori, M. Hirao, and M. Nishiyama, "High-Frequency Wireless and Electrodeless Quartz Crystal Microbalance Developed as Immunosensor", Jpn. J. Appl. Phys. 46, 4693-4697 (2007).
- H. Ogi, K. Motohisa, T. Matsumoto, K. Hatanaka, and M. Hirao, "Isolated Electrodeless High-Frequency Quartz Crystal Microbalance for Immunosensors", Anal. Chem. 78, 6903-6909 (2006).
- H. Ogi, K. Motohisa, T. Matsumoto, T. Mizugaki, and M. Hirao, "Wireless electrodeless piezomagnetic biosensor with an isolated nickel oscillator", Biosens. Bioelectron. 21, 2001-2005 (2006).