培養細胞用に対する超音波局所力学刺激システムの開発 最終更新:2026年1月16日
I. 背景: メカノバイオロジーとは
全ての細胞は,重力はもちろん,血液流によるせん断力や筋肉の伸縮による伸長力・収縮力などの様々な力を受けています.細胞はこれらの力に応じて自身の形態や機能を変化させながら生命活動を維持しています.細胞が力を感知すると,それに関連する生化学シグナルが活性化され,細胞機能が変化すると考えられています.この過程における詳細なエカニズムを解明する学問を「メカノバイオロジー」と呼び,細胞に力学刺激として人為的に力を与えて細胞への影響を調べる研究が行われています.力に対する細胞の応答を知ることができれば,適切な条件の力学負荷を細胞に与えることで細胞機能を制御し,目的の細胞を確実に培養することが可能となるため,健康で均質な細胞培養が求められる細胞治療や再生医療の発展,創薬スクリーニングに貢献することが期待されます.
II. 細胞の力学刺激法における課題
複数の反応が重畳する複雑な細胞環境において,力学負荷と細胞応答の関係を完全に理解することにはさまざまな困難があり,未解明なことが多く残っているのが現状です.重大な困難の一つは,細胞に力学刺激を与える手法の技術的課題です.現在では様々な優れた力学刺激技術が提案されており,実験目的に応じて取捨選択する必要がありますが,各技術には欠点もあります.我々は,力学刺激方法における次の3つの要件に着目しています.
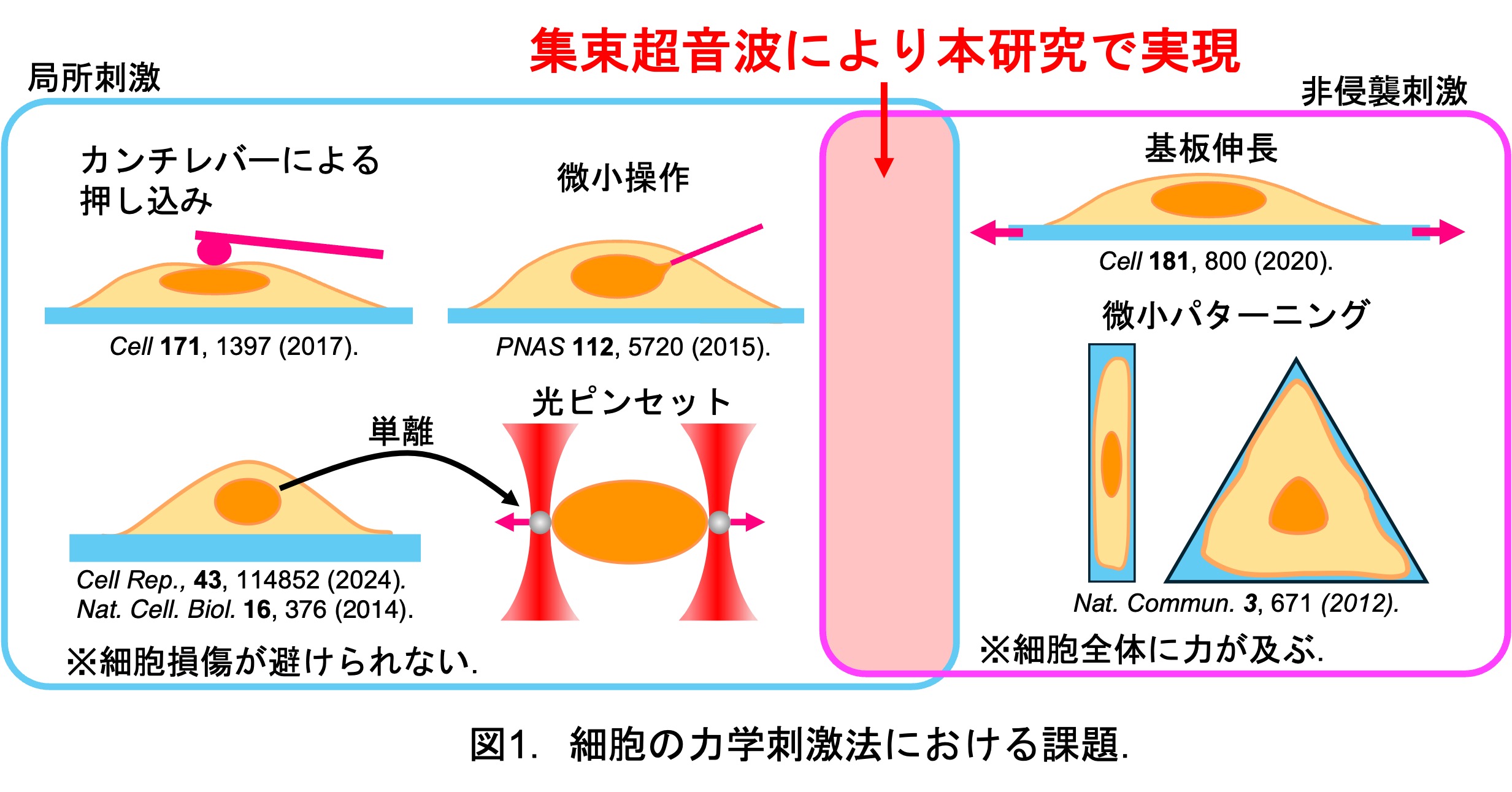
- 細胞本来の培養状態を維持することが可能な非侵襲的手法であること.(細胞に力学刺激を加える際,細胞に接触することによって細胞を損傷してしまうと,力学刺激に対する細胞応答の時間依存性を長期的に調査することが困難となります.)
- 刺激対象の部位のみを選択的に刺激可能であること.(細胞応答のメカニズム解明には,細胞全体で刺激に応答しているのか,特定の細胞小器官が応答しているのかを明確にするため,刺激対象の部位のみを局所的に刺激する必要があります.)
- 刺激度合いの定量と制御が可能であること.(細胞応答は刺激の大きさや刺激時間,頻度に依存して変化すると考えられ,再現性の高い実験をするためには刺激の度合いを精密に制御することが必要です.)
しかし,先行研究で主に利用されている力学刺激方法は,AFMカンチレバーによる押し込み刺激や基板伸長といった非侵襲性または局所性に欠け,上記3つの要件を全て満たす手法は確立されていませんでした(図1参照).
Ⅲ. 超音波局所力学刺激システム開発
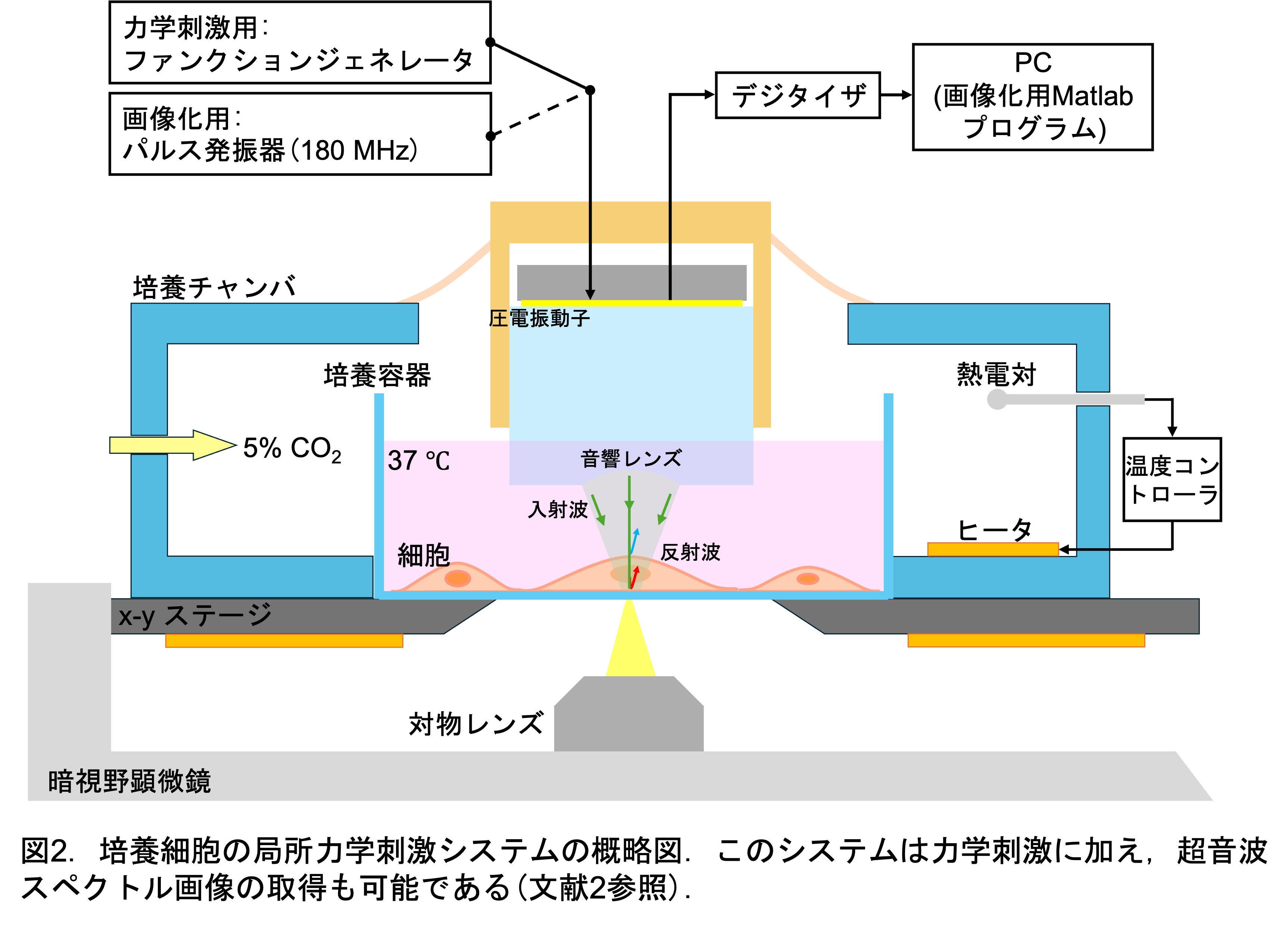
我々は,集束超音波が3つの要件を全て満たすことができる現状では唯一の手法であると考え,刺激度合いの精密な制御が可能で,非侵襲かつ局所的な細胞の力学刺激を可能とする培養細胞用超音波システムを独自に開発しました(図2参照).このシステムでは音響レンズにより超音波の照射スポットを5-10 μmに集束させ,刺激条件に応じた周波数や振幅の超音波を細胞に照射して非接触に局所力学刺激を与えることが可能です.力学刺激は,アクリル性培養チャンバを自作し,細胞の生存に適した環境下(37 ℃,5%CO2)で実施することができるため,同じ細胞に対して長期的(24時間以上)に力学刺激を与えることができます.さらに,培養容器の下側から光学顕微鏡観察により細胞状態や刺激位置を確認しながら実験することが可能です.
このように,我々は細胞を培養しながら非侵襲・非接触で,細胞の局所部分に力学刺激が可能なシステムを開発しました.つまり,このシステムを利用することにより,細胞損傷の影響を含まず,力学刺激の影響のみを細胞培養初期から分化後まで長期的に調査することが可能となりました.(文献1参照)
Ⅳ. 力学刺激の実行
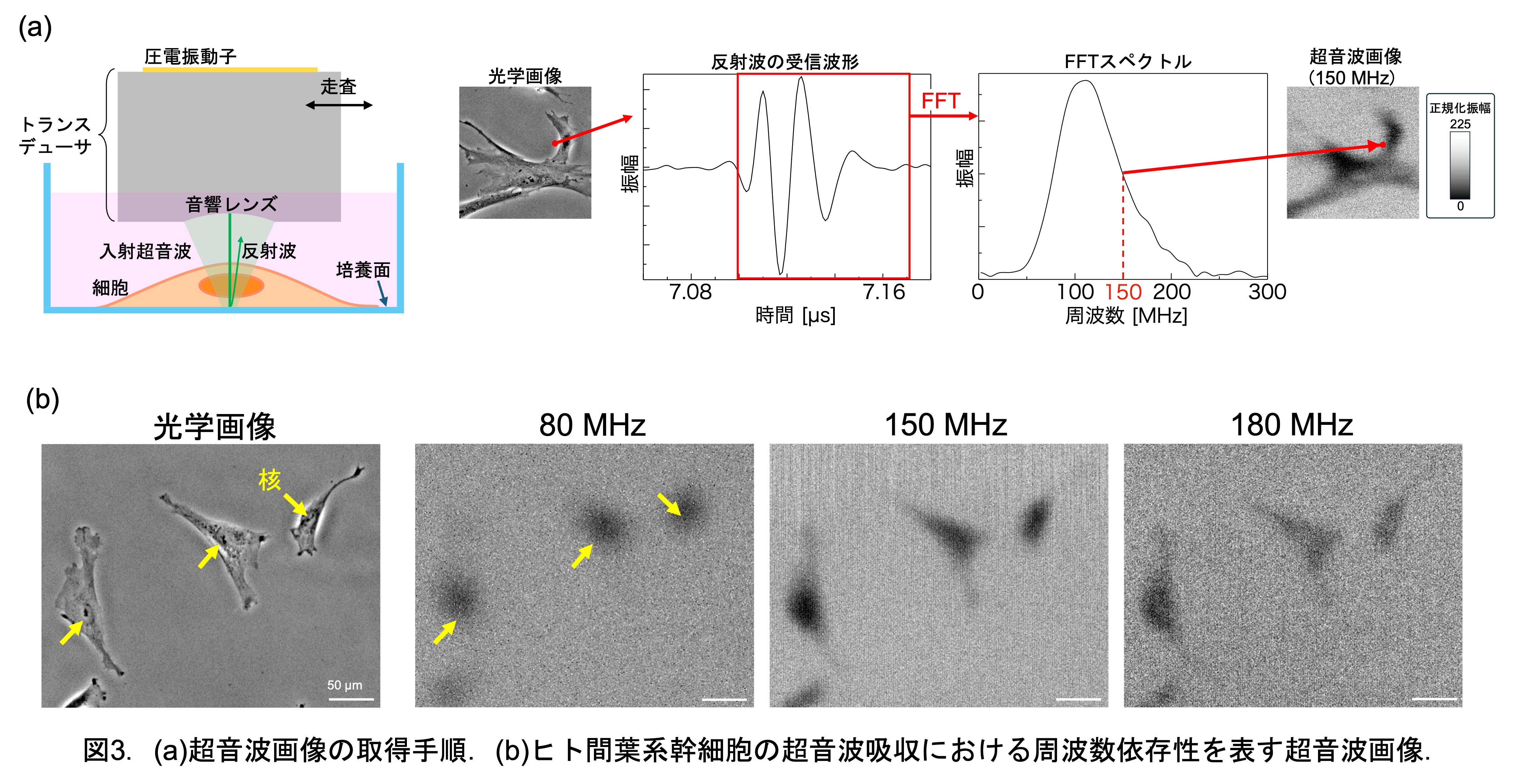
我々ははじめに,効率よく力学刺激が与えられる超音波条件を選定するため,細胞の超音波吸収に対する周波数依存性を調べました.図3(a)に示すように細胞を透過し,培養面で反射した超音波の振幅の大小関係を周波数ごとに画像にしました.図3(b)にその画像を示し,黒い部分ほどその周波数の超音波をその位置でよく吸収していることを示します.ここで我々は,これらの超音波画像と光学画像を比較し,周波数が高い180 MHzの画像では超音波は細胞全体で吸収されている一方で,周波数が低い80-150 MHzの画像では核付近でのみ特異的に吸収されることを発見しました.この核での特異的な吸収の原因を特定するため,核を半径7 μmの弾性球体と仮定して膨張圧縮振動の一次共振周波数を算出したところ,110 MHzとなり,核の吸収帯と一致しました.このことは,核の大きさの不均一さや細胞質での超音波減衰を考慮すると,核は80-150 MHz付近の超音波照射により共振し,超音波エネルギーを大きく吸収することを意味します.したがって,この周波数帯の超音波を細胞に照射することにより,核のみを選択的に力学刺激することができる可能性を示しました.(文献1参照)
Ⅴ. この後の展開
開発したシステムを用いて実際に核の力学刺激に適用し,核への選択的な力学刺激が細胞機能に与える影響の解明を目指します.刺激の影響は細胞構造や遺伝子発現の変化といった生物学的観点だけでなく,物理学系専攻としての強みを生かして細胞の力学特性変化といった物理学的観点からの評価指標を取り入れることで,より深い議論ができると考えています.そのために現在は超音波システムを改良し,核の力学刺激と同時に,核の粘弾性計測を可能とする実験系の確立に取り組んでいます(文献3参照).
なお,本研究はJSPS科研費 基盤研究(S)JP24H00045の助成を受けて行われました.
<参考文献>
- N. Fujiwara, S. Y. Tan, T. Matsumoto, A. Nagakubo, M. Kino-oka, and H. Ogi "Development of a focused-ultrasound spectroscopic-imaging system combined with optical imaging for applying mechanical stimulation on living cells and possibility of selective stimulation for nucleus", Jp. J. Appl. Phys. 63, 03SP65 (2024).
- N. Fujiwara, T. Matsumoto, A. Nagakubo, S. Y. Tan, M. Kino-oka, and H. Ogi, "Time course observation of cross sectional shape of iPS cell colony using ultrasound spectroscopic imaging", npj Biol. Phys. Mech. 2, 1 (2025).
- N. Fujiwara, H. Okita, M. Uno, K. Adachi, K. Nakajima, N. Nakamura, M. H. Kim, M. Kino-oka, K. Ogawa, K. Ikenaka, H. Ogi, "Focused acoustic-radiation-force microscopy for live-cell selective nucleus deformation and nucleus viscoelasticity measurement", bioRxiv (https://doi.org/10.1101/2025.10.23.681068).