アミロイド線維と難病 最終更新:2023年1月18日

図1. アミロイド線維の原子間力顕微鏡画像 (画像提供:大阪大学 後藤祐児先生(1))
表1. 代表的なアミロイドーシスと原因蛋白質
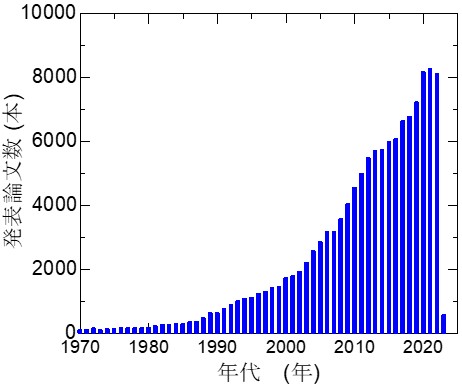
図2. PubMedにおいてamyloidで検索した際の論文数の推移
アミロイド線維(Amyloid fibril)は、変性蛋白質が作る結晶性の凝集体で図1に示すような針状の形態を示します。構成蛋白質の種類にもよるのですが、およそ直径10 nmで線維軸に沿って一次元的に成長することができ、十分成長したものでは長さ数 μmに到達します。さらに拡大してみると、このアミロイド線維は規則的に変性蛋白質が整列した螺旋状の構造を示します。軸方向には、蛋白質の種類に寄らず、4.7-4.9 Å (10-10 m)の間隔で整列し、水素結合で連なっています。また、近年では、クライオ電子顕微鏡(Cryo electron microscopy)の技術の発展により、面内に密に並んだアミノ酸側鎖の原子配置までが報告されるようになっています。
アミロイド線維は美しい構造を示すのですが、我々の体の中で作られると重大な病気を引き起こしてしまいます。アミロイド線維によって引き起こされる病気はアミロイドーシス(Amyloidosis)と総称されます。現在、30を超えるアミロイドーシスが報告されており、アルツハイマー病やパーキンソン病がその代表です。これらは治療が確立されていない疾患であり、非常に大きな社会問題となっています。また、最近では、心アミロイドーシスなどが話題になりました。これらの疾患は、すべてアミロイド線維によって引き起こされますが、アミロイド線維を構成する蛋白質が疾患によって異なります。代表的なアミロイドーシスと原因蛋白質を右の表にまとめます。
これらの蛋白質の一部は、健常者の体の中では生命を維持するために働いているのですが、アミロイドーシス患者の体内ではアミロイド線維へと姿を変えてしまいます。このアミロイド線維は脳や内臓・関節などに蓄積し、生体機能に問題を引き起こします。アミロイド線維は多くの疾患の原因物質ですので、体の中でなぜ・どのようにして作られるを理解し、アミロイドーシスを予防することが重要ですが、未解明の事柄が多く残るのが現状です。近年の論文数(図2)からもうかがえるように、アミロイド線維に関する研究は、難病の根治を通して、私たちの生活の質(Quality of Life: QOL)を上げることに直結することが期待されるために、様々な研究が世界中で行われております。
我々の研究グループでは、独自の超音波装置や蛋白質科学の分析手法を用いて、アミロイド線維の物性や形成過程を明らかにすること、また、開発した装置を臨床診断や創薬研究に応用することを目指し、アミロイド線維の研究に取り組んでいます。
- 参考文献
(1) H. Kato et al., "The role of disulfide bond in the amyloidogenic state of β2-microglobulin studied by heteronuclear NMR", Protein Sci. 11, 2218-2229 (2002).